Par le Dr Mikael Cohen (CRC SEP, service de neurologie, CHU de Nice)
En résumé
■ Le diagnostic de sclérose en plaques est porté de plus en plus précocement grâce à de nouvelles techniques d’imagerie et de biologie. Cependant, une évaluation neurologique et radiologique, idéalement par une équipe expérimentée dans la prise en charge de la maladie, est indispensable pour réduire le risque d’erreur diagnostique.
■ Le délai de mise en route d’un traitement de fond efficace est un facteur majeur dans l’amélioration du pronostic fonctionnel. Chaque molécule présente un profil de rapport bénéfices-risques spécifique et des biomarqueurs permettent de choisir le traitement adéquat pour un patient donné et au bon moment.
■ La gestion des risques médicamenteux est un élément majeur de la prise en charge. Cela implique notamment la mise à jour du calendrier vaccinal et la réalisation de vaccinations additionnelles selon la classe thérapeutique choisie.
■ L’éducation thérapeutique du patient et la pratique d’une activité physique régulière sont des éléments importants de la prise en charge, dès le début de la maladie.
La sclérose en plaques (SEP) est une maladie auto-immune chronique affectant le système nerveux central. Il s’agit de la première cause de handicap non traumatique de l’adulte jeune.
À travers cet article, nous aborderons les grandes évolutions de la prise en charge et leur impact sur la pratique.
FACTEURS DÉCLENCHANTS
La SEP est une pathologie multifactorielle sous-tendue par des facteurs de susceptibilité génétique et environnementaux.
Parmi les éléments phares publiés dans la littérature récente, on notera l’importance du virus Epstein-Barr (EBV). En effet, la prévalence du portage EBV chez les patients atteints de SEP est proche de 100 %. Récemment, une étude de cohorte observationnelle menée sur des militaires américains a montré, dans le sous-groupe des sujets qui étaient séronégatifs pour le virus EBV lors de l’inclusion et qui avaient développé une SEP au cours du suivi, que le démarrage de la maladie était constamment associé à une séroconversion pour le virus EBV. Il est également démontré qu’une primo-infection tardive et symptomatique sous la forme d’une mononucléose infectieuse augmente le risque d’évolution vers la SEP (1).
Parmi les autres facteurs environnementaux associés au développement de la maladie, on notera également le rôle péjoratif de la carence en vitamine D3, du tabac et de l’obésité notamment dans l’enfance (2).
À ce jour, il n’existe cependant aucune mesure de prévention ou de dépistage à l’échelle individuelle, y compris chez les apparentés de patients.
DIAGNOSTIC
Les progrès des techniques d’imagerie et de biologie permettent aujourd’hui de poser le diagnostic de sclérose en plaques de plus en plus précocement.
Cela représente un enjeu et un progrès majeur car les traitements modificateurs de la maladie dont nous disposons procurent un bénéfice d’autant plus important sur le pronostic à long terme qu’ils sont instaurés précocement après les premiers symptômes.
Le diagnostic de sclérose en plaques ne repose pas sur un seul examen mais sur un faisceau d’arguments cliniques et paracliniques démontrant, après avoir écarté les diagnostics différentiels potentiels en cas de drapeaux rouges, l’existence d’une pathologie affectant l’ensemble du système nerveux central (dissémination spatiale), de manière évolutive (dissémination temporelle).
> Présentation clinique
La SEP a longtemps été présentée comme une pathologie affectant essentiellement les capacités ambulatoires, démarrant le plus souvent sous une forme récurrente rémittente et pouvant parfois évoluer vers une forme secondairement progressive
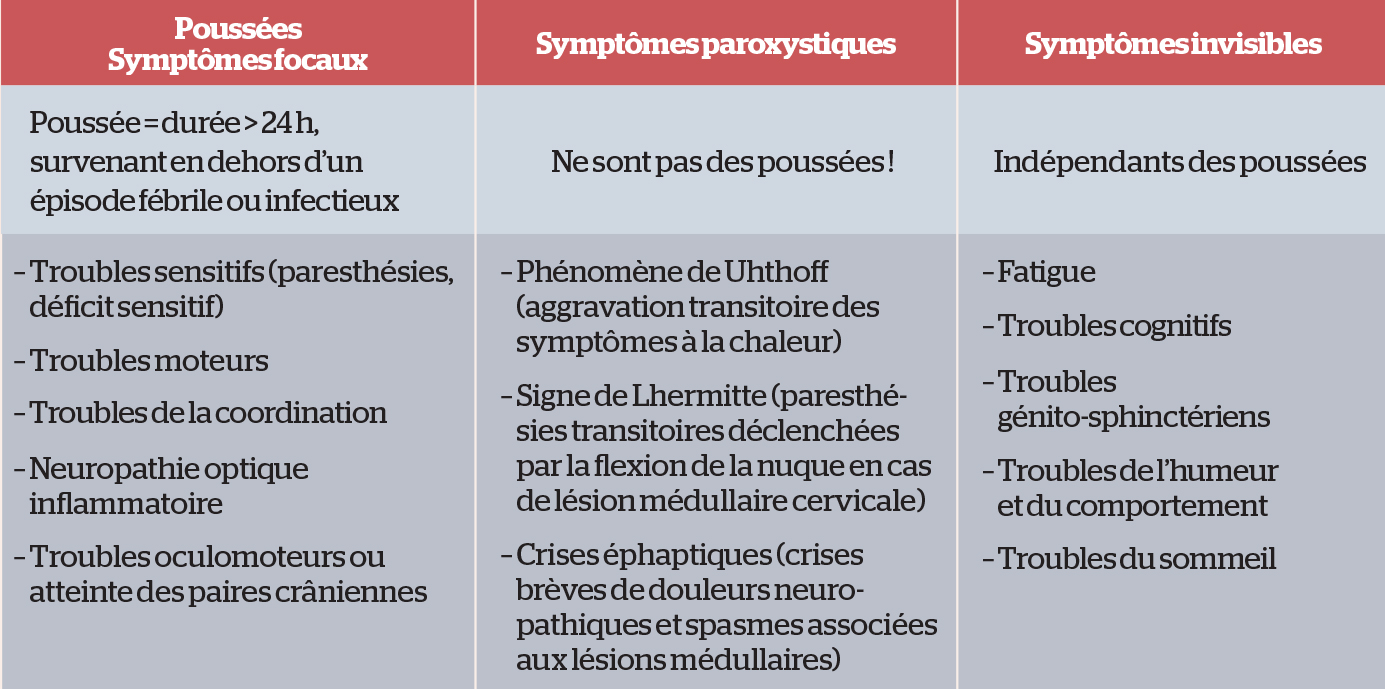
Ce concept est actuellement largement remis en question (3, 4). Tout d’abord, de plus en plus d’arguments immunologiques, cliniques et radiologiques démontrent que les mécanismes inflammatoires focaux à l’origine des poussées et l’inflammation diffuse et insidieuse à l’origine du versant progressif neurodégénératif coexistent dès le début de la maladie mais peuvent varier au cours de l’évolution. Ainsi, le statut phénotypique des patients doit être réévalué de manière régulière.
D’autre part, les connaissances sur la maladie mettent en évidence de nombreux symptômes dits « invisibles », pouvant évoluer indépendamment des poussées. Ces symptômes sont souvent sous-déclarés par les patients et parfois méconnus bien qu’ils puissent être invalidants et altérer significativement la qualité de vie. On retiendra notamment la fatigue, les troubles cognitifs et les troubles génito-sphinctériens qui doivent être systématiquement recherchés. Une prise en charge spécifique peut être proposée pour chacune de ces problématiques.
Les principales manifestations cliniques sont résumées dans le tableau ci-dessous :
> Les critères diagnostiques
● Les éléments nécessaires au diagnostic sont définis dans les critères de McDonald, mis à jour tous les 4 à 5 ans en moyenne. La dernière version de ces critères a été présentée en septembre 2024 lors du congrès international de l’Ectrims (5). Leur publication est en attente à l’heure de la rédaction de cet article
● L’analyse de la situation clinique est évidemment la première étape indispensable au diagnostic.
En l’absence de symptomatologie clinique évocatrice, la situation correspond le plus souvent à une découverte fortuite d’anomalies non spécifiques de la substance blanche. La découverte d’un processus inflammatoire au stade pré-clinique est possible mais extrêmement rare (syndrome radiologique isolé) et cette situation doit, quoi qu’il arrive, être confirmée par une prise en charge dans un Centre de ressources et compétences pour la SEP (6).
● Lorsque la situation clinique est évocatrice, l’imagerie par résonance magnétique (IRM) cérébrale, médullaire et des voies optiques antérieures représente la pierre angulaire du diagnostic, montrant des anomalies de la substance blanche évocatrices d’un processus inflammatoire démyélinisant affectant les principales topographies d’intérêt classiquement concernées par la pathologie : les régions périventriculaires, juxtacorticales, la fosse postérieure, la moelle épinière et les nerfs optiques. L’atteinte de plusieurs de ces topographies permet d’affirmer l’existence d’une dissémination dans l’espace.
Parallèlement, la dissémination dans le temps est prouvée par l’existence de lésions multiples et d’âges différents (par exemple, présence sur un même examen de lésions rehaussées et non rehaussées par le gadolinium, ou encore apparition de nouvelles lésions T2 Flair sur un suivi longitudinal).
À noter aussi que dès lors qu’une pathologie inflammatoire du système nerveux central est suspectée, un protocole standardisé d’imagerie doit être appliqué pour garantir une qualité optimale et une comparabilité entre les différents examens (7, 8).
● En complément de l’IRM conventionnelle, l’analyse du liquide céphalo-rachidien (LCR) est le deuxième examen majeur permettant de porter le diagnostic. La présence de bandes oligoclonales surnuméraires ou la présence d’une synthèse intrathécale de chaînes légères libres kappa peuvent, dans certaines situations, se substituer au critère de dissémination temporelle.
La ponction lombaire peut également permettre d’écarter certains diagnostics différentiels, voire apporter des éléments pronostiques, et elle est donc largement pratiquée dans les centres experts.
Au total, dans une très grande majorité des cas, la présence de lésions dans au moins deux topographies d’intérêt en IRM, associée à une dissémination temporelle ou à une positivité du LCR, permettra d’affirmer rapidement le diagnostic de sclérose en plaques et d’introduire un traitement de fond.
Dans le cas contraire, des techniques d’imagerie avancée, généralement réservées aux centres de neuroradiologie spécialisés, pourront être employées pour apporter des arguments supplémentaires permettant d’augmenter la spécificité du diagnostic, notamment en démontrant le caractère veino-centré des lésions ou en montrant une activation inflammatoire macrophagique en périphérie des lésions sous la forme d’un anneau paramagnétique.
Enfin, à défaut, un suivi clinique et radiologique sera proposé au patient dans l’attente de pouvoir statuer formellement sur le diagnostic.
PRISE EN CHARGE
La prise en charge de la SEP a largement évolué au cours des dernières décennies. L’émergence de nombreuses thérapeutiques de haute efficacité, combinée à la précocité du diagnostic et de l’introduction du traitement, a permis d’améliorer significativement le pronostic fonctionnel à moyen et long termes.
En contrepartie, l’exposition précoce et prolongée à des traitements immunosuppresseurs requiert une rigueur dans le suivi et la minimisation des risques, notamment infectieux.
> Les traitements de fond
● Il existe aujourd’hui de nombreuses molécules approuvées pour le traitement de fond des formes actives de sclérose en plaques (avec poussées et/ou activité focale en IRM).
Les traitements immunomodulateurs injectables historiques (interféron bêta, acétate de glatiramère) sont de moins en moins utilisés au profit de nouvelles molécules. Plusieurs traitements de haute efficacité, en particulier les anticorps monoclonaux dirigés contre le VLA4 (natalizumab) ou les lymphocytes B (ocrélizumab, ofatumumab), peuvent être proposés selon les caractéristiques cliniques et radiologiques de la maladie. Ces thérapeutiques apportent une efficacité rapide et une garantie très élevée sur la réduction du risque de nouvelles poussées et d’activité radiologique de la maladie. Ils n’ont pas d’efficacité prouvée sur le versant progressif.
● Le choix du traitement de fond se détermine en fonction des caractéristiques de la maladie et des comorbidités éventuelles. Certains biomarqueurs existent pour affiner la balance bénéfices-risques à l’échelle individuelle. C’est pourquoi le parcours de soins du patient – tel que défini par les agences régionales de santé – et les recommandations internationales soulignent l’importance d’une décision partagée et d’une validation des traitements de haute efficacité par les centres experts (9).
> Gestion des risques liés aux traitements
● L’exposition précoce et prolongée à des traitements immunosuppresseurs s’accompagne d’une stratégie de minimisation et de surveillance des risques, notamment sur le plan infectieux, carcinologique ou sur des situations particulières telles que le désir de grossesse. Chaque molécule dispose d’un plan de gestion de risques spécifiques. En addition, la Société francophone de la sclérose en plaques a établi des recommandations concernant la prévention des risques infectieux, la gestion du risque de cancer et du désir de grossesse (10-14).
Les principales molécules disposant d’une AMM en 2024 et leurs effets secondaires sont résumés dans le tableau ci-dessous:

● Une attention particulière doit être donnée à la question des vaccinations. Alors qu’il existe depuis longtemps une réticence des patients vis-à-vis des vaccinations en général en raison d’une controverse sur le déclenchement potentiel de la sclérose en plaques causé par le vaccin contre l’hépatite B, les données de la littérature démontrent clairement l’innocuité à utiliser les vaccins, et à l’inverse, leur efficacité pour minimiser les risques infectieux (14). La mise à jour du calendrier vaccinal est un élément majeur dans la gestion des risques chez les patients exposés à des traitements immunosuppresseurs et certaines vaccinations additionnelles peuvent être requises en fonction de la classe thérapeutique choisie, notamment la vaccination contre la grippe saisonnière, le Covid-19 ou le pneumocoque.
> Prise en charge symptomatique
De nombreux progrès ont également été constatés ces dernières années dans la prise en charge des symptômes résiduels de la maladie. Une approche multidisciplinaire impliquant les médecins MPR, kinésithérapeutes, neuropsychologues, neuro-urologues demeure primordiale.
● De nouvelles thérapeutiques symptomatiques ont été mises sur le marché pour la prise en charge des troubles urinaires, de la douleur ou de la spasticité. L’hyperactivité vésicale peut être accessible à des traitements anticholinergiques de nouvelle génération, présentant moins d’effets secondaires. Des solutions non médicamenteuses telles que la neurostimulation peuvent également être utilisées. Concernant la douleur et la spasticité réfractaire, une expérimentation a été mise en place en France pour l’utilisation des dérivés cannabinoïdes. L’usage de la toxine botulique peut également avoir une indication dans ces trois situations.
● Concernant la prise en charge non médicamenteuse, une attention particulière doit être donnée à la rééducation fonctionnelle et surtout à la pratique d’une activité physique régulière (16). Il a en effet été démontré que la pratique d’une activité physique régulière (idéalement 20 à 30 minutes, trois fois par semaine au minimum) permettait d’améliorer la condition physique et la fatigue ressentie par les patients. Certains travaux suggèrent même un effet immunomodulateur et anti-inflammatoire qui pourrait jouer un rôle protecteur sur l’activité de la maladie, ainsi qu’un effet visant à promouvoir la remyélinisation. Le type d’activité physique peut être laissé au choix du patient et lorsque la situation le nécessite, la prescription d’une prise en charge en activité physique adaptée peut être proposée. Dans tous les cas, une vérification préalable de l’absence de contre-indication générale à la pratique du sport est impérative.
Sur le plan diététique, aucune mesure spécifique n’est préconisée en dehors des recommandations de population générale et aucune preuve scientifique ne permet d’encourager la pratique d’un régime alimentaire particulier.
Une aide au sevrage tabagique et une supplémentation de la carence en vitamine D3 doivent être proposées le cas échéant.
> Perspectives
Malgré un arsenal thérapeutique conséquent, de nombreuses molécules sont encore en développement pour le traitement de fond de la maladie ainsi que sur le versant symptomatique. Certaines sont dérivées de classes thérapeutiques existantes et visent à améliorer la tolérance, le profil de risque ou le confort du patient. D’autres ont pour ambition d’agir sur le versant progressif de la maladie, voire de conférer un rôle neuroprotecteur ou encore de promouvoir la remyélinisation. Aucune molécule n’a apporté de preuve formelle d’efficacité à ce stade. Par ailleurs, les greffes de cellules souches à visée remyélinisante n’ont pas démontré d’efficacité pour le moment.
CONCLUSION
La prise en charge a évolué vers un diagnostic et une prise en charge de plus en plus précoces, ayant eu pour conséquence d’améliorer significativement le pronostic fonctionnel des patients. Dans ce contexte, le rôle du généraliste sera de détecter les symptômes de la maladie et d’orienter le patient vers une prise en charge spécialisée, mais aussi de participer à la prise en charge, notamment dans la prévention des complications infectieuses des traitements immuno-actifs.
PRINCIPAUX ACTEURS ET PARCOURS DE SOINS
• La Société francophone de la SEP (https://sfsep.org) a été créée en 2015. Elle a des missions d’enseignement, de recherche et d’homogénéisation des pratiques. Elle propose régulièrement des recommandations de bonne pratique sur une thématique spécifique.
• La prise en charge de la SEP a été intégrée au plan Maladies neurodégénératives (PMND) de 2014, ce qui a abouti à la labellisation de Centres de ressources et compétences pour la sclérose en plaques (CRC SEP). Les CRC SEP sont implantés dans chaque région au sein d’un CHU. Ils constituent un recours régional vers lequel les patients peuvent être orientés pour une prise en charge diagnostique ou thérapeutique. Les CRC SEP ont également pour mission de garantir l’accès aux programmes de recherche clinique et aux programmes d’éducation thérapeutique.
Chaque CRC SEP dispose de son parcours de soins défini en fonction des spécificités propres à chaque région, en s’appuyant notamment sur des réseaux de soins et parfois sur des centres associés. Il organise régulièrement des réunions de concertation à visée diagnostique et thérapeutique.
• Depuis 2017, un financement de l’Agence nationale de la recherche (ANR) a permis de mettre en place l’Observatoire français de la sclérose en plaques (OFSEP, https://www.ofsep.org). Il s’agit d’un outil épidémiologique à grande échelle permettant de répondre à des questions telles que l’évolution de l’incidence de la maladie, les facteurs pronostiques ou le rapport bénéfices-risques des traitements en condition de vie réelle. Les CRC SEP ont également pour mission d’être garants de la participation des patients à cet observatoire.
• Concernant la recherche clinique, un réseau spécifique multidisciplinaire, FCRIN4MS (https://www.fcrin4ms.org), a été mis en place pour optimiser la participation des patients à des programmes de recherche clinique.
• Enfin, trois des principales associations de patients se sont réunies en 2024 pour former la Fondation France Sclérose en plaques.
Bibliographie
1. Bjornevik K, Cortese M, Healy BC, et al. Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis. Science. 2022;375:296–301.
2. Waubant E, Ponsonby A-L, Pugliatti M, Hanwell H, Mowry EM, Hintzen RQ. Environmental and genetic factors in pediatric inflammatory demyelinating diseases. Neurology. 2016;87:S20–S27.
3. Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple sclerosis: The 2013 revisions. Neurology. 2014;83:278–286.
4. Thompson AJ, Moccia M, Amato MP, et al. Do the current MS clinical course descriptors need to change and if so how? A survey of the MS community. Mult Scler J. 2023;29:1363–1372.
5. ECTRIMS 2024. Oral Presentations. Mult Scler J. 2024;30:4–124.
6. Lebrun-Frénay C, Okuda DT, Siva A, et al. The radiologically isolated syndrome: revised diagnostic criteria. Brain. 2023;146:3431–3443.
7. Brisset J-C, Kremer S, Hannoun S, et al. New OFSEP recommendations for MRI assessment of multiple sclerosis patients: Special consideration for gadolinium deposition and frequent acquisitions. J Neuroradiol. 2020;47:250–258.
8. Cotton F, Kremer S, Hannoun S, Vukusic S, Dousset V, (OFSEP) for the IWG of the « Observatoire français de la sclérose en plaques ». OFSEP, a nationwide cohort of people with multiple sclerosis: Consensus minimal MRI protocol. J Neuroradiol. 2015;42:133–140.
9. Montalban X, Gold R, Thompson AJ, et al. Ectrims/EAN guideline on the pharmacological treatment of people with multiple sclerosis. Eur J Neurol [online serial]. 2018;25:215–237.
10. Lebrun-Frenay C, Carra-Dallière C, Louapre C, et al. Recommandations de la Société francophone de la sclérose en plaques « Vaccinations et sclérose en plaques » : mise à jour 2024. Prat Neurol - FMC. 2024;15:105–113.
11. Vukusic S, Carra-Dalliere C, Ciron J, et al. Pregnancy and multiple sclerosis: 2022 recommendations from the French multiple sclerosis society. Mult Scler J. 2022;29:11–36.
12. Papeix C, Donzé C, Lebrun-Frenay C, group F. Recommandations de la SFSEP « Infections et sclérose en plaques » : quel bilan préthérapeutique ? Rev Neurol. 2021;177:S154.
13. Donzé C, Papeix C, Lebrun-Frenay C, et al. Urinary tract infections and multiple sclerosis: Recommendations from the French Multiple Sclerosis Society. Rev Neurol. 2020;176:804–822.
14. Lebrun C, Vukusic S, (SFSEP) FG for R in MS (France4MS) and the SF de la SEP. Immunization and multiple sclerosis: Recommendations from the French multiple sclerosis society. Mult Scler Relat Disord. 2019;31:173–188.
15. Filippini G, Minozzi S, Borrelli F, Cinquini M, Dwan K. Cannabis and cannabinoids for symptomatic treatment for people with multiple sclerosis. Cochrane Database Syst Rev. 2022;5:CD013444.
16. Kalb R, Brown TR, Coote S, et al. Exercise and lifestyle physical activity recommendations for people with multiple sclerosis throughout the disease course. Mult Scler J. 2020;26:1459–1469.
17. Lenne B, Donze C, Massot C, Degraeve B. Impact of physical activity, physical fitness and exercises on cognitive impairment in patients with multiple sclerosis: A review of evidence and underlying mechanisms. Rev Neurol. 2024;180:583–598.


CCAM technique : des trous dans la raquette des revalorisations
Dr Patrick Gasser (Avenir Spé) : « Mon but n’est pas de m’opposer à mes collègues médecins généralistes »
Congrès de la SNFMI 2024 : la médecine interne à la loupe
La nouvelle convention médicale publiée au Journal officiel, le G à 30 euros le 22 décembre 2024