INTRODUCTION
La péricardite constrictive est une pathologie rare et grave avec une morbimortalité importante. La prévalence et l’incidence exactes sont méconnues, sa fréquence varie entre 0,5 et 2 % des cardiopathies.
Toutes les péricardites aiguës peuvent éventuellement évoluer vers une forme constrictive. On estime notamment que 0,2 à 2,4 % des patients développeront une péricardite constrictive après chirurgie cardiaque. Il semble exister une certaine prédominance masculine (1).
Après un bref rappel physiopathologique, nous voudrions insister sur le caractère protéiforme de cette pathologie, sa découverte tardive due à sa rareté, sa symptomatologie clinique atypique, l’échec à court terme du traitement pharmacologique et l’optimisation du traitement chirurgical. De plus, rappeler que ce sont des patients à haut risque nécessitant une surveillance clinique accrue.
ÉTIOLOGIE
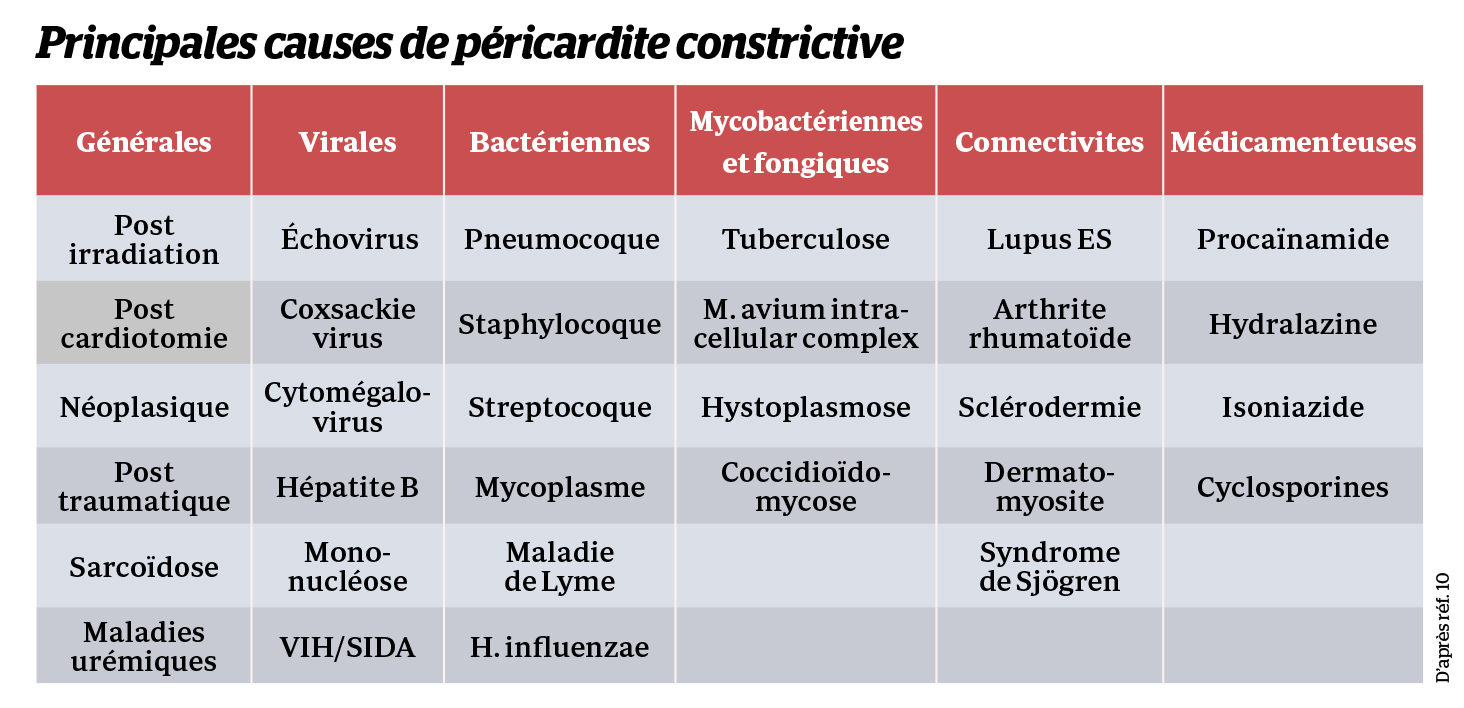
Les étiologies sont nombreuses car la péricardite constrictive représente l’aboutissement final de l’évolution des péricardites aiguës ou des épanchements péricardiques quelle que soit la cause, avec une prépondérance pour les étiologies post-infectieuses (purulentes et tuberculeuses) ou idiopathiques mais aussi un accroissement des causes iatrogènes : post-chirurgie cardiaque et radiothérapie thoracique et après procédures de cardiologie interventionnelle (2). Le tableau ci-dessous résume les principales étiologies.
Une origine génétique a été décrite dans certains rares syndromes à transmission autosomique récessive (type nanisme de Mulibrey ou syndrome CACP - camptodactyly-arthropathy-coxa vara-pericarditis) touchant respectivement les gènes impliqués dans les protéines de connexion des peroxysomes ou la sécrétion de protéoglycane (3).
PHYSIOPATHOLOGIE
Sur le plan physiopathologique, la péricardite constrictive est la conséquence de l’inflammation chronique puis de la transformation fibreuse du péricarde. Elle peut associer ou non un épaississement péricardique. Environ 20 % des péricardites constrictives ont un péricarde d’épaisseur normale ≤ 2 mm et des calcifications des deux feuillets du péricarde qui sont symphysés. Le péricarde devient une coque rigide inextensible entravant le remplissage ventriculaire méso- et télédiastolique, à l’origine d’un syndrome d’adiastolie (1, 4).
La constitution d’une gangue fibro-calcique isolant le massif cardiaque du reste des organes intra-thoraciques entraîne deux phénomènes principaux : une dissociation entre les pressions intrathoraciques et intracardiaques et une exagération de l’interdépendance ventriculaire lors des mouvements respiratoires, avec comme corollaire une augmentation importante de la pression au niveau de l’oreillette droite (1, 2).
Le délai entre l’atteinte péricardique inflammatoire initiale et le développement d’une péricardite constrictive est très variable, allant de plusieurs jours à plusieurs mois, voire plusieurs années. Dans les formes évoluées et/ou dans les formes post-radiothérapie thoracique, on observe une extension du processus fibrosant vers le myocarde entraînant sa dysfonction et aggravant de surcroît le pronostic même après une chirurgie réussie. En plus, au stade final, il est très difficile de connaître l’étiologie initiale, qui reste le plus souvent présomptive, où tous les éléments clinico-biologiques sont non spécifiques même sur les prélèvements biopsiques péricardiques (5).
En cas de péricardite aiguë, certains facteurs prédictifs d’évolution vers une forme constrictive ont été identifiés, à savoir un syndrome inflammatoire plus grave (plus de fièvre et épanchement péricardique important ou persistant sous traitement) ou échec précoce du traitement anti-inflammatoire. Certaines comorbidités prédisposent à l’évolution vers la chronicité comme l’insuffisance rénale chronique avec des dépôts calcaires péricardiques et la persistance d'une fréquence cardiaque élevée auto-entretenant l’inflammation (1).
SYMPTOMATOLOGIE ET DIAGNOSTIC
De façon générale, la péricardite constrictive représente un syndrome clinique constitué de symptômes et signes peu sensibles et peu spécifiques incluant fatigue, dyspnée d’effort, palpitations, ainsi que de signes de rétention hydrosodée, prise de poids avec œdème des membres inférieurs, distension abdominale avec ascite et épanchements pleuraux réalisant dans l’extrême un tableau d’anasarque avec congestion à la fois veineuse et systémique qui peut se compliquer de cirrhose cardiaque et d’entéropathie exsudative.
L’examen clinique peut retrouver certains éléments d’orientation : turgescence spontanée des jugulaires avec hépatomégalie pulsatile, vibrance péricardique. Le pouls paradoxal et le signe de Kussmaul ne sont pas spécifiques car retrouvés dans d’autres pathologies (4).
Cela explique que sa reconnaissance est difficile aussi bien par les cardiologues que par les autres praticiens, d’où l’énorme retard diagnostique, avec un délai moyen de 20 mois. De plus, certains patients sont suivis à tort comme porteurs de pathologies hépato-gastro intestinales telles la cirrhose ou l’entéropathie exsudative (4).
La péricardite constrictive doit être évoquée devant toute insuffisance cardiaque droite inexpliquée dans un contexte clinique évocateur et a fortiori devant une ascite récidivante riche en protides. Dans presque 20 % des cas, une ascite n’est pas liée à une cirrhose, elle est la conséquence de pathologies diverses locales ou générales et la démarche diagnostique et étiologique est basée au-delà de l’examen clinique, essentiellement sur la ponction et l’analyse spécialisée du liquide d’ascite car il permet d’évoquer une origine cardiaque (qui représente 3 % des cas dans les pays développés et est la 3e cause d’ascite aux États-Unis) en cas de liquide riche en protides (avec un seuil à 25 g/L) et un gradient sérum-ascite d’albumine élevé supérieur à 11 g/L, liée à l’hypertension portale causée par un bloc sus-hépatique post-sinusoïdale (6,7). C’est donc grâce à l’analyse biologique du liquide d’ascite que l’on oriente le diagnostic de péricardite constrictive.
Le diagnostic final reste un diagnostic d’élimination, après avoir écarté d’autres pathologies confondantes, notamment la cardiomyopathie restrictive et toutes les pathologies pouvant être responsables d’insuffisance cardiaque à prédominance droite (insuffisance tricuspide sévère, embolie pulmonaire avec cœur pulmonaire aiguë, défaillance cardiaque droite).
Parmi les examens complémentaires : l’électrocardiogramme est presque toujours pathologique. Les anomalies les plus fréquentes associent un microvoltage, des troubles non spécifiques de la repolarisation, de la conduction intra-auriculaires ou des arythmies supra-ventriculaires et notamment la fibrillation atriale.
La radiographie thoracique peut apporter des éléments diagnostiques importants si elle met en évidence des calcifications péricardiques. Celles-ci sont présentes chez 25-30 % des patients. La silhouette cardiaque est souvent normale, des épanchements pleuraux sont visualisés dans 35-50 % des cas (8).
Le diagnostic a été amélioré par l’utilisation des différentes techniques d’imagerie cardiaque dont l’échocardiographie. Celle-ci sera complétée par un scanner thoracique et le plus souvent par une IRM cardiaque et si nécessaire un cathétérisme cardiaque.
L’échocardiographie représente l’outil principal de l’évaluation initiale de toute insuffisance cardiaque. Elle permet d’identifier les anomalies structurelles et hémodynamiques rencontrées dans la péricardite constrictive. Le plus souvent, d’autres techniques d’imagerie non invasives comme le scanner thoracique et l’IRM cardiaque permettent de poser le diagnostic, de mesurer l’épaisseur du péricarde et d’autre part de détecter et visualiser l’extension des calcifications péricardiques et/ou de l’inflammation (9).
Le cathétérisme cardiaque reste d’actualité. Il doit être complet, droit et gauche, avec mesure et enregistrement des courbes de pressions isolées et en simultané des cavités cardiaques droites et gauches en inspiration libre et lors des mouvements respiratoires et, si besoin, inclure une épreuve de remplissage vasculaire chez les patients déplétés. Le paramètre discriminant permettant d’affirmer le diagnostic de péricardite constrictive prouvée chirurgicalement avec une sensibilité de 97 % et une valeur prédictive positive (VPP) de 100 % est l’index de surface systolique > 1,1 (rapport surface VD/surface VG entre inspiration et expiration).
PRISE EN CHARGE
Le traitement pharmacologique initial fait appel aux corticoïdes stéroïdiens et non stéroïdiens (AINS), à la colchicine, aux diurétiques – y compris ceux de l’anse en cas de forte rétention hydriques – et aux antidouleurs en cas d’exacerbation douloureuse. Mais à plus au moins court terme, le traitement médicamenteux est mis en échec et laisse la place à la péricardectomie chirurgicale.
Cette chirurgie doit être réalisée dans des centres expérimentés. Elle consiste à libérer le cœur de sa compression externe par une péricardectomie la plus complète possible, afin d’éviter en théorie la récidive. Elle permet une amélioration symptomatique chez une partie importante de patients.
La péricardectomie précoce avec décortication complète constitue donc le traitement de choix. Un travail publié dernièrement portant sur 93 patients confirme les très bons résultats post-chirurgicaux (10). Cependant, la mortalité à 30 jours après l’intervention est estimée entre 5 à 10 %, et à 20 % à 10 ans.
Certains facteurs de mauvaise évolution au long terme ont été identifiés. Il s’agit le plus souvent de sujets âgés, sexe féminin, sévérité de la constriction, stade NYHA élevé, fibrillation atriale, résection péricardique incomplète, dysfonction VG aiguë en postopératoire, patients ayant nécessité une cardioversion électrique externe en urgence, ou calcifications péricardiques post-radiothérapie (11,12).
SURVEILLANCE
Si, en post-opératoire, le patient sera revu par son cardiologue habituel, qui adaptera le traitement en fonction des examens électriques et échocardiographiques, le suivi par le médecin traitant sera beaucoup plus large, visant non seulement à diagnostiquer une récidive mais aussi à motiver, conseiller, intervenir sur les différents facteurs de risque, à s’assurer du bon suivi pharmacologique, etc.
Interrogatoire et examen clinique minutieux doivent s’attacher à repérer la réapparition éventuelle de la symptomatologie clinique (douleur thoracique, dyspnée, récupération difficile après effort même modéré, apparition de fièvre, etc.) suggérant une récidive. Toutes les modifications à l’auscultation cardiaques et/ou pulmonaires sont à explorer. Ne pas hésiter à demander de l’aide au confrère cardiologue.
CONCLUSION
La péricardite constrictive est une pathologie rare mais grave, avec une morbimortalité importante. Il s’agit le plus souvent de l’évolution terminale d’une péricardite aiguë. Le caractère aspécifique de la symptomatologie clinique a pour corollaire un retard diagnostique de plusieurs mois. Nous voudrions insister, d’une part, sur la forte suspicion diagnostique de péricardite constrictive devant toute insuffisance cardiaque récidivante à prédominance droite, et d’autre part, souligner l’intérêt d’une analyse biologique systématique du liquide d’ascite, car elle peut être révélatrice d’une affection extra-hépatique, notamment cardiaque, pour laquelle une prise en charge adaptée peut permettre la guérison.
Sur le plan diagnostique, outre l’examen clinique, il faut souligner l’apport de l’échocardiographie et de l’imagerie en coupe comme le scanner et surtout l’IRM qui a l’avantage de discriminer cardiopathies restrictive et constrictive.
Sur le plan thérapeutique, soulignons l’échec du traitement médical et l’effet spectaculaire de la péricardectomie chirurgicale.
EN RÉSUMÉ
- La péricardite constrictive est une pathologie rare, caractérisée par un épaississement rigide du péricarde limitant la compliance myocardique.
- Les principales étiologies sont les infections du péricarde, la radiothérapie thoracique et la chirurgie cardiaque.
- Cliniquement, elle présente les classiques signes d’insuffisance cardiaque. Signes par ailleurs aspécifiques pouvant ainsi retarder le diagnostic de plusieurs mois.
- La démarche diagnostique fait appel, au-delà de l’examen clinique, à l’échocardiographie, à l’imagerie en coupe (scanner et IRM) et au cathétérisme cardiaque. Sur le plan biologique, une ascite riche en protides avec un gradient albumine sérum-ascite élevé semble être un bon signe évocateur.
- Son diagnostic est primordial et constitue un véritable challenge car il représente l’une des rares étiologies potentiellement soignables d’insuffisance cardiaque diastolique,via la péricardectomie.
Dr Alberto Tiritilli (professeur au collège de médecine des Hôpitaux de Paris) atiritilli@free.fr
BIBLIOGRAPHIE
1. Syed FF, Schaff HV, Oh JK. Constrictive pericarditis a curable diastolic heart failure. Nat Rev Cardiol, 2014; 11:530-44.
2. Myers RB, Spodick DH. Constrictive pericarditis: clinical and pathophysiologic characteristics. Am Heart J, 1999; 138(2 Pt 1): 219-32.
3.Pyeritz RE, Genetics and Cardiovascular Disease in: Braundwald E (2001) Heart disease: a textbook of cardiovascular medicine. Philadelphia, PA:W.B. Saunders. Pp 19-96.
4.Troughton RW, Asher CR, Klein AL. Pericarditis. Lancet, 2004; 363:717–27.
5.Nataf P, Cacoub P, Dorent R, et al. Results of subtotal pericardiectomy for constrictive pericarditis. Eur J Cardiothorac Surg, 1993; 7(5):252-5.
6.Runyon BA. Care of patients with ascites. N Engl J Med, 1994; 330:337-42.
7. Carrier P, Jacques J, Debette-Gratien M, Legros R, Sarabi M, Vidal E, Sautereau D, Bezanahary H, Ly KH, Loustaud-Ratti V. L’ascite non liée à la cirrhose: physiopathologie, diagnostic et étiologies. Rev Med Interne 2014; 35(6):365-71.
8.Gournay G, Illouz E. Péricardite chronique constrictive. EMC-Cardiologie 1999 :1-15 [Article 11-016-A-10].
9.Cremer PC, Kwon DH. Multimodality imaging of pericardial disease. Curr Cardiol Rep. 2015; 17(4):24.
10. Depboylu BC, Mootoosamy P, Vistarine N, Testuz A, Hamamsy IE, Cikirikcioglu M. Surgical Treatment of Constrictive Pericarditis. Tex Heart Inst J, 2017; 1 44 (2) : 101-106.
11. Bertog SC, Thambidorai SK, Parakh K et al. Constrictive pericarditis: etiology and cause-specific survival after pericardiectomy. J Am Coll Cardiol, 2004; 43:1445-1452.
12. Cho YH, Schaff HV. Surgery for pericardial disease. Heart Fail Rev, 2013; 18 (3): 375-87.
L'auteur déclare n'avoir aucun lien d'intérêt relatif au contenu de cet article


En 5 points
Crise psycho-comportementale dans les maladies neurocognitives
Cas clinique
La miliaire rouge
Étude & Pratique
Pas d’aspirine chez le coronarien stenté déjà anticoagulé
En 5 points
Le refus scolaire anxieux